一种检测幽门螺杆菌耐药突变位点的试剂盒和方法与流程
本发明属于生物制品领域,特别涉及一种检测幽门螺杆菌耐药突变位点的试剂盒与方法。
背景技术:
幽门螺杆菌(Helicobacter pylori,Hp)是世界上流行范围最广的病原体,全世界大约有50%的人感染了幽门螺杆菌,而在我国有40%-70%的人群感染幽门螺杆菌。幽门螺杆菌主要引起胃肠道消化系统相关疾病,如慢性胃炎、胃溃疡、十二指肠溃疡、胃癌等等。目前对幽门螺杆菌的治疗主要采用含有抗生素的三联或四联疗法进行,而随着抗生素的大量使用,幽门螺杆菌已经出现了抗生素的耐药现象。因此,幽门螺杆菌的耐药检测对临床用药的指导具有重要意义。
目前临床上检测幽门螺杆菌是否耐药主要为药敏试验,即通过培养Hp与不同抗生素进行体外反应从而确定其最低抑菌浓度来判断是否耐药。药敏试验的大致步骤为:从病人的感染部位采取含致病菌的标本,接种在适当的培养基上,于一定条件下培养;同时将分别沾有一定量各种抗生素的纸片贴在培养基表面(或用不锈钢圈,内放定量抗生素溶液),培养一定时间后观察结果。由于致病菌对各种抗生素的敏感程度不同,在药物纸片周围便出现不同大小的抑制病菌生长而形成的“空圈”,称为抑菌圈。抑菌圈大小与致病菌对各种抗生素的敏感程度成正比关系。然后根据试验结果有针对性地选用抗生素。
但是上述幽门螺杆菌药敏试验首先需要对幽门螺杆菌进行培养。二幽门螺旋杆菌是一种螺旋形、微厌氧、对生长条件要求十分苛刻的革兰氏阴性杆菌,因此幽门螺杆菌的培养难度大,操作复杂,且耗时较长(药敏试验整个过程通常需要1-2周)。因此,导致幽门螺杆菌的药敏试验成本高,灵敏度低,特别难以满足对幽门螺杆菌的常用药物克拉霉素和喹诺酮类抗生素的耐药性临床检测的要求。
技术实现要素:
有鉴于此,本发明的一个目的在于针对上述临床上对幽门螺杆菌最常用的药物克拉霉素和喹诺酮类抗生素,提出一种针对这几种药物高频耐药基因的位点开发的,费用低、速度快的幽门螺杆菌耐药性检测技术。
因此,本发明的第一目的在于提供一种检测幽门螺杆菌耐药突变位点的试剂盒,包括以下组分:
喹诺酮类抗生素耐药位点突变引物探针与阻滞序列;
和/或克拉霉素类抗生素耐药位点突变引物探针与阻滞序列;
和/或与上述引物探针相匹配的PCR试剂组
优选地,本发明检测幽门螺杆菌耐药突变位点的试剂盒中,所述被检测的喹诺酮类抗生素耐药位点突变包括:幽门螺杆菌gyrA基因喹诺酮耐药位点突变A259T、幽门螺杆菌gyrA基因喹诺酮耐药位点突变T261G、幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271A、幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271T、与幽门螺杆菌gyrA基因喹诺酮耐药位点突变A272G中一种或几种。
更优选地,本发明检测幽门螺杆菌耐药突变位点的试剂盒中,所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A259T的引物探针序列为(对应于序列表的SEQ ID NO1~NO3):
259-F:5’ACCACCCCCATGGCGATT3’
259-R:5’CGCCATCAATAGAGCCAAAGTG3’
259-P:5’GAGAATGGCGCAAGATTTTTCCATGCG3’;
与所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A259T引物探针序列对应的阻滞序列((对应于序列表的SEQ ID NO4)为:
259-blocker:5’GGTAAATACCACCCCCATGGCGATA3’-NH2C6;
所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变T261G的引物探针序列(对应于序列表的SEQ ID NO5~NO7)为:
261-F:5’ACCACCCCCATGGCGATTAG3’
261-R:5’CGCCATCAATAGAGCCAAAGTG3’
261-P:5’GAGAATGGCGCAAGATTTTTCCATGCG3’;
与所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变T261G引物探针序列对应的阻滞序列(对应于序列表的SEQ ID NO8)为:
261-blocker:5’GGTAAATACCACCCCCATGGCGATAAT3’-NH2C6;
所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271A的引物探针序列(对应于序列表的SEQ ID NO9~NO11)为:
271A-F:5’CCATGGCGATAATGCGGTTTTTA3’
271A-R:5’CGCCATCAATAGAGCCAAAGTG3’
271A-P:5’GAGAATGGCGCAAGATTTTTCCATGCG3’
与所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271A引物探针序列对应阻滞序列(对应于序列表的SEQ ID NO12)为:271A-blocker:
5’ACCCCCATGGCGATAATGCGGTTTATG3’-NH2C6;
所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271T的引物探针序列(对应于序列表的SEQ ID NO13~NO15)为:
271T-F:5’CCATGGCGATAATGCGGTTTTTA 3’
271T-R:5’CCATGGCGATAATGCGGTTTTTT 3’
271T-P:5’GAGAATGGCGCAAGATTTTTCCATGCG3’
与所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271T引物探针序列对应的阻滞序列(对应于序列表的SEQ ID NO16)为:
271T-blocker:5’ACCCCCATGGCGATAATGCGGTTTATG3’-NH2C6;
所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A272G的引物探针序列(对应于序列表的SEQ ID NO17~NO19)为:
272-F:5’CATGGCGATAATGCGGTTTAAGG 3’
272-R:5’CCATGGCGATAATGCGGTTTTTT 3’
272-P:5’GAGAATGGCGCAAGATTTTTCCATGCG3’
与所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A272G引物探针序列对应的阻滞序列(对应于序列表的SEQ ID NO20)为:
272-blocker:5’ACCCCCATGGCGATAATGCGGTTTATGA3’-NH2C6。
更优选地,所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A259T的引物探针序列259-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变T261G的引物探针序列261-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271A的引物探针序列271A-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271T的引物探针序列271T-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A272G的引物探针272-P的5’端、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A259T的引物探针序列259-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变T261G的引物探针序列261-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271A的引物探针序列271A-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271T的引物探针序列271T-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A272G的引物探针272-P的3’端为被荧光修饰集团所修饰。
本发明所用的荧光修饰集团可使用FAM(6-羧基荧光素),HEX(六氯-6-甲基荧光素)、VIC、ROX、Cy3(TYETM563)、Cy5(TYETM665)的一种或几种。
最优选地,所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A259T的引物探针序列259-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变T261G的引物探针序列261-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271A的引物探针序列271A-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271T的引物探针序列271T-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A272G的引物探针272-P的5’端被HEX集团修饰,所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A259T的引物探针序列259-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变T261G的引物探针序列261-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271A的引物探针序列271A-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变G271T的引物探针序列271T-P、所述幽门螺杆菌gyrA基因喹诺酮耐药位点突变A272G的引物探针272-P的3’端被BHQ1集团修饰。
优选地,本发明检测幽门螺杆菌耐药突变位点的试剂盒中,所述检测的克拉霉素类抗生素耐药位点突变包括:幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142C、幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142G、幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2143G的一种或几种。
更优选地,本发明检测幽门螺杆菌耐药突变位点的试剂盒中,所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142C的引物探针序列(对应于序列表的SEQ ID NO21~NO23)为:
2142C-F:5’TCCTACCCGCGGCAAGACTGC 3’
2142C-R:5’CCATAAGAGCCAAAGCCCTTACTTCA 3’
2142C-P:5’TGGGAATATCATGCGCAGGATAGGTGGGAG 3’
与所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142C的引物探针序列的阻滞序列(对应于序列表的SEQ ID NO24)为:
2142C-blocker:5’TCCTCCTACCCGCGGCAAGACGGA 3’-NH2C6;所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142G的引物探针序列(对应于序列表的SEQ ID NO25~NO27):
2142G-F:5’CTACCCGCGGCAAGACTGG 3’
2142G-R:5’CCATAAGAGCCAAAGCCCTTACTTCA 3’
2142G-P:5’TGGGAATATCATGCGCAGGATAGGTGGGAG 3’
与所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142G的引物探针序列对应的阻滞序列(对应于序列表的SEQ ID NO28)为:
2142G-blocker:5’TCCTCCTACCCGCGGCAAGACGGA 3’-NH2C6;
所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2143G的引物探针序列(对应于序列表的SEQ ID NO29~NO31)为:
2143-F:5’TACCCGCGGCAAGACGTAG 3’
2143-R:5’CCATAAGAGCCAAAGCCCTTACTTCA 3’
2143-P:5’TGGGAATATCATGCGCAGGATAGGTGGGAG 3’
与所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2143G的引物探针序列对应的阻滞序列(对应于序列表的SEQ ID NO32)为:
2143-blocker:5’TCCTCCTACCCGCGGCAAGACGGAA3’-NH2C6;
更优选地,所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142C的引物探针序列2142C–P、所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142G的引物探针序列2142G–P、所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2143G的引物探针序列2143–P的5’端、所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142C的引物探针序列2142C–P、所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142G的引物探针序列2142G–P、所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2143G的引物探针序列2143–P的3’端为被荧光修饰集团所修饰。
最优选地,所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142C的引物探针序列2142C–P、所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142G的引物探针序列2142G–P、所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2143G的引物探针序列2143–P的5’端被FAM集团修饰,所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142C的引物探针序列2142C–P、所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2142G的引物探针序列2142G–P、所述幽门螺杆菌23SrRNA基因克拉霉素耐药位点突变A2143G的引物探针序列2143–P的3’端被BHQ1集团修饰。
更优选地,本发明检测幽门螺杆菌耐药突变位点的试剂盒中,所述PCR试剂组包括dNTP、DNA聚合酶、PCR缓冲液。
最优选地,本发明检测幽门螺杆菌耐药突变位点的试剂盒中,所述PCR试剂组包括:按反应体系为25μL计,所述引物探针与阻滞序列的浓度为0.1μM~0.5μM;优选地,所述探针浓度为0.1μM~0.5μM;所述DNA聚合酶0.06μM~0.3μM;所述PCR缓冲液包括:Tris浓度为1.0mM~2.0mM;KCl浓度为1.0mM~2.0mM;Mg2+浓度为0.6μM~3.0μM;所述dNTP浓度为2.0-2.5μM。
本发明的另一目的在于提供一种检测幽门螺杆菌耐药突变位点的方法,包括以下步骤:
1)提取被试样品中的幽门螺杆菌的DNA;
2)利用权利要求1~7任意一项所述的试剂盒,对步骤1)获得的被试样品幽门螺杆菌DNA进行荧光PCR(;
3)通过荧光PCR的结果判断是否发生耐药性突变。
9、根据权利要求6所述的方法,其特征在于,所述荧光PCR的条件为95℃2min进行变性反应;95℃10s,55℃40s,40个循环,在55℃40s阶段收集荧光信号。
本发明还提供了上述试剂盒在检测幽门螺杆菌对喹诺酮类抗生素和/或克拉霉素类抗生素中的应用。
由上可知,本发明至少具有以下优点:
1)本发明设计的幽门螺杆菌核酸及耐药检测采用荧光PCR的方法进行,灵敏度高,耗时短(一般仅需要2-3小时),对目前临床上对幽门螺杆菌的耐药检测具有很大的优势。
2)本发明检测幽门螺杆菌耐药突变位点的试剂盒与方法,具有灵敏度高,特异性强的优点,如本发明后续实施例所证明,本发明的试剂盒检测灵敏度可以达到1000拷贝/mL。
附图说明
图1为实施例1检测幽门螺杆菌gyrA基因A259T位点突变的PCR扩增图;
图2为实施例2检测幽门螺杆菌gyrA基因T261G位点突变的PCR扩增图;
图3为实施例3检测幽门螺杆菌gyrA基因G271A位点突变的PCR扩增图;
图4为实施例4检测幽门螺杆菌gyrA基因G271T位点突变的PCR扩增图;
图5为实施例5检测幽门螺杆菌A272G基因位点突变的PCR扩增曲线图;
图6为实施例6检测幽门螺杆菌A2142C基因位点突变的PCR扩增曲线图;
图7为实施例7检测幽门螺杆菌A2142G基因位点突变的PCR扩增曲线图;
图8为实施例8检测幽门螺杆菌A2143G基因位点突变的PCR扩增曲线图。
具体实施方式
以下通过具体实施例进一步对本发明的技术方案进行说明,应理解以下仅为本发明的示例性说明,并不用于限制本发明权利要求的保护范围。
实施例1本发明试剂盒对幽门螺杆菌gyrA基因259位点突变耐药性的检测
1.试验样品的确定
将利用药敏试验检测为幽门螺杆菌喹诺酮耐药,且通过测序比对证明gyrA259位点由A突变为T的临床样本作为待检样品。采用柱法或磁珠法抽提幽门螺杆菌基因组DNA,分装后贮存于-80℃。
2.引物和探针的设计:
设计了多对引物和探针,引物长度一般为15-30碱基。
幽门螺杆菌喹诺酮基因gyrA耐药突变位点A259T引物探针与阻滞序列如下:
上游引物259-F:5’ACCACCCCCATGGCGATT3’
下游引物259-R:5’CGCCATCAATAGAGCCAAAGTG3’
探针259-P:5’HEXGAGAATGGCGCAAGATTTTTCCATGCGBHQ13’
阻滞序列259-blocker:5’GGTAAATACCACCCCCATGGCGATA3’-NH2C6
3.反应体系的优化
3.1引物浓度的优化
在反应体系中其它条件相同的情况下,将259位点引物浓度分别从0.06μM至0.48μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳引物浓度是0.24μM。
3.2探针浓度的优化
在反应体系中其它条件相同的情况下,将259探针浓度分别从0.03μM至0.24μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳探针浓度是0.12μM。
利用上述引物和探针进行反应体系的建立,最后确定采用的幽门螺杆菌耐药突变检测实时荧光PCR反应体系为25μL。
按照一步法荧光定量PCR试剂盒说明进行反应液的配置:
Tris(1M):1μL;KCl(1M):2μL;dNTP(2.5mM):2μL;259-F(20μM):0.3μL;259-R(20μM):0.3μL;259-P(20μM):0.15μL;DNA聚合酶(5U):0.4;H2O:13.85μL;合计:20μL;模板:5μL。
4.仪器检测通道的选择
选择的荧光检测通道应与探针所标记的报告荧光基团一致,具体按照仪器使用说明书进行设置。
5.PCR反应条件如下
95℃2min进行变性反应;95℃10s,55℃40s,40个循环,在55℃40s阶段收集荧光信号。
6.检测结果分析
待检样本中的幽门螺杆菌gyrA基因259位点由A突变为T,显示阳性扩增曲线,其检测灵敏度可以达到1000拷贝/mL;
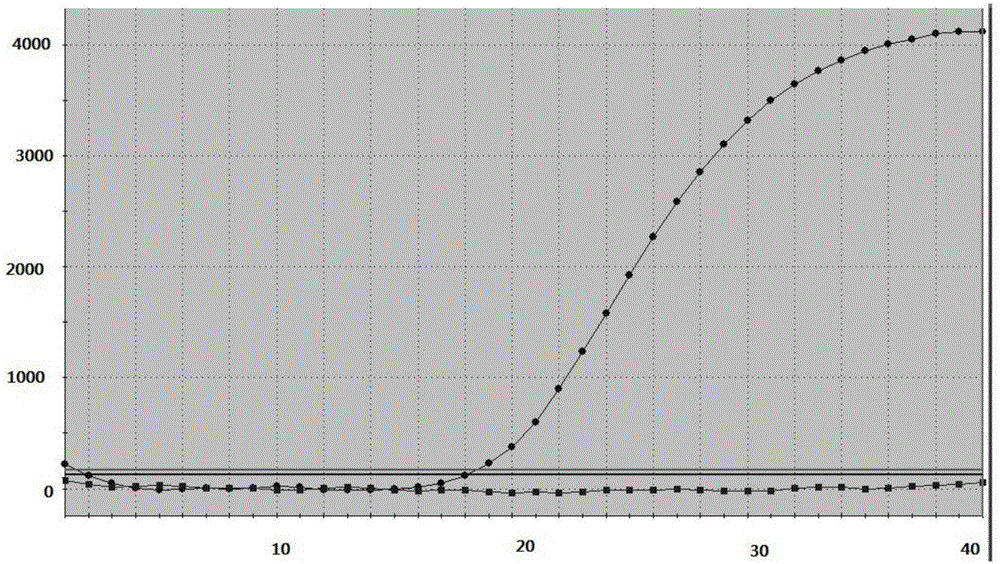
在对照样本中没有幽门螺杆菌或者幽门螺杆菌gyrA基因259位点未发生由A至T的突变,显示阴性扩增曲线,即无扩增信号,提示上述引物对和探针具有良好的特异性和灵敏度。如图1所示:其中上面曲线为gyrA259位点突变样本扩增曲线,Ct值为18.3;下面曲线为野生型样本扩增曲线,NO Ct(即无Ct值,下同)。
实施例2本发明试剂盒对幽门螺杆菌gyrA基因261位点突变耐药性的检测
1.试验样品的确定
将利用药敏试验检测为幽门螺杆菌喹诺酮耐药,且通过测序比对证明gyrA261位点由T突变为G的临床样本作为待检样品。采用柱法或磁珠法抽提细菌基因组DNA,分装后贮存于-80℃。
2.引物和探针的设计:
设计了多对引物和探针,引物长度一般为15-30碱基。
本实施例幽门螺杆菌喹诺酮基因gyrA耐药突变位点T261G引物探针与阻滞序列如下:
261-F:5’ACCACCCCCATGGCGATTAG3’
261-R:5’CGCCATCAATAGAGCCAAAGTG3’
261-P:5’HEXGAGAATGGCGCAAGATTTTTCCATGCGBHQ13’
阻滞序列261-blocker:
5’GGTAAATACCACCCCCATGGCGATAAT3’-NH2C6;
3.反应体系的优化
3.1引物浓度的优化
在反应体系中其它条件相同的情况下,将261位点引物浓度分别从0.06μM至0.48μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳引物浓度是0.24μM。
3.2探针浓度的优化
在反应体系中其它条件相同的情况下,将261探针浓度分别从0.03μM至0.24μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳探针浓度是0.12μM。
利用上述引物和探针进行反应体系的建立,最后确定采用的幽门螺杆菌耐药突变检测实时荧光PCR反应体系为25μL。
按照一步法荧光定量PCR试剂盒说明进行反应液的配置:
Tris(1M):1μL;KCl(1M):2μL;dNTP(2.5mM):2μL;261-F(20μM):0.3μL;261-R(20μM):0.3μL;261-P(20μM):0.15μL;DNA聚合酶(5U):0.4;H2O:13.85μL;合计:20μL;模板:5μL。
4.仪器检测通道的选择
选择的荧光检测通道应与探针所标记的报告荧光基团一致,具体按照仪器使用说明书进行设置。
5.PCR反应条件如下
95℃2min进行变性反应;95℃10s,55℃40s,40个循环,在55℃40s阶段收集荧光信号。
6.检测结果分析
待检样本中的幽门螺杆菌gyrA基因261位点由T突变为G,显示阳性扩增曲线,其检测灵敏度可以达到1000拷贝/mL;
在对照样本中没有幽门螺杆菌或者幽门螺杆菌gyrA基因261位点未发生由T至G的突变,显示阴性扩增曲线,即无扩增信号,提示上述引物对和探针具有良好的特异性和灵敏度。如图2所示:其中上面曲线为gyrA261位点突变样本扩增曲线,Ct值为17.8;下面曲线为野生型样本扩增曲线,NO Ct。
实施例3本发明试剂盒对幽门螺杆菌gyrA基因271位点突变耐药性的检测
1.试验样品的确定
将利用药敏试验检测为幽门螺杆菌喹诺酮耐药,且通过测序比对证明gyrA271位点由G突变为A的临床样本作为待检样品。采用柱法或磁珠法抽提细菌基因组DNA,分装后贮存于-80℃。
2.引物和探针的设计:
设计了多对引物和探针,引物长度一般为15-30碱基。
本实施例幽门螺杆菌喹诺酮基因gyrA耐药突变位点G271A引物探针与阻滞序列如下:
271A-F:5’CCATGGCGATAATGCGGTTTTTA3’
271A-R:5’CGCCATCAATAGAGCCAAAGTG3’
271A-P:5’HEXGAGAATGGCGCAAGATTTTTCCATGCGBHQ13’
阻滞序列271A-blocker:
5’ACCCCCATGGCGATAATGCGGTTTATG3’-NH2C6;
3.反应体系的优化
3.1引物浓度的优化
在反应体系中其它条件相同的情况下,将271位点引物浓度分别从0.06μM至0.48μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳引物浓度是0.24μM。
3.2探针浓度的优化
在反应体系中其它条件相同的情况下,将271探针浓度分别从0.03μM至0.24μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳探针浓度是0.12μM。
利用上述引物和探针进行反应体系的建立,最后确定采用的幽门螺杆菌耐药突变检测实时荧光PCR反应体系为25μL。
按照一步法荧光定量PCR试剂盒说明进行反应液的配置:
Tris(1M):1μL;KCl(1M):2μL;dNTP(2.5mM):2μL;271A-F(20μM):0.3μL;271A-R(20μM):0.3μL;271A-P(20μM):0.15μL;DNA聚合酶(5U):0.4;H2O:13.85μL;合计:20μL。模板:5μL。
4.仪器检测通道的选择
选择的荧光检测通道应与探针所标记的报告荧光基团一致,具体按照仪器使用说明书进行设置。
5.PCR反应条件如下
95℃2min进行变性反应;95℃10s,55℃40s,40个循环,在55℃40s阶段收集荧光信号。
6.检测结果分析
待检样本中的幽门螺杆菌gyrA基因271位点由G突变为A,显示阳性扩增曲线,其检测灵敏度可以达到1000拷贝/mL;
在对照样本中没有幽门螺杆菌或者幽门螺杆菌gyrA基因271位点未发生由G至A的突变,显示阴性扩增曲线,即无扩增信号,提示上述引物对和探针具有良好的特异性和灵敏度。如图3所示:其中上面曲线为gyrA271位点突变样本扩增曲线,Ct值为16.9;下面曲线为野生型样本扩增曲线,NO Ct。
实施例4本发明试剂盒对幽门螺杆菌gyrA基因271位点突变耐药性的检测
1.试验样品的确定
将利用药敏试验检测为幽门螺杆菌喹诺酮耐药,且通过测序比对证明gyrA271位点由G突变为T的临床样本作为待检样品。采用柱法或磁珠法抽提细菌基因组DNA,分装后贮存于-80℃。
2.引物和探针的设计:
设计了多对引物和探针,引物长度一般为15-30碱基。
本实施例幽门螺杆菌喹诺酮基因gyrA耐药突变位点G271T引物探针与阻滞序列如下:
271T-F:5’CCATGGCGATAATGCGGTTTTTA 3’
271T-R:5’CCATGGCGATAATGCGGTTTTTT 3’
271T-P:5’HEXGAGAATGGCGCAAGATTTTTCCATGCGBHQ13’
阻滞序列271T-blocker:
5’ACCCCCATGGCGATAATGCGGTTTATG3’-NH2C6;
3.反应体系的优化
3.1引物浓度的优化
在反应体系中其它条件相同的情况下,将271位点引物浓度分别从0.06μM至0.48μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳引物浓度是0.24μM。
3.2探针浓度的优化
在反应体系中其它条件相同的情况下,将271探针浓度分别从0.03μM至0.24μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳探针浓度是0.12μM。
利用上述引物和探针进行反应体系的建立,最后确定采用的幽门螺杆菌耐药突变检测实时荧光PCR反应体系为25μL。
按照一步法荧光定量PCR试剂盒说明进行反应液的配置:
Tris(1M):1μL;KCl(1M):2μL;dNTP(2.5mM):2μL;271T-F(20μM):0.3μL;271T-R(20μM):0.3μL;271T-P(20μM):0.15μL;DNA聚合酶(5U):0.4;H2O:13.85μL;合计:20μL;模板:5μL。
4.仪器检测通道的选择
选择的荧光检测通道应与探针所标记的报告荧光基团一致,具体按照仪器使用说明书进行设置。
5.PCR反应条件如下
95℃2min进行变性反应;95℃10s,55℃40s,40个循环,在55℃40s阶段收集荧光信号。
6.检测结果分析
待检样本中的幽门螺杆菌gyrA基因271位点由G突变为T,显示阳性扩增曲线,其检测灵敏度可以达到1000拷贝/mL;
在对照样本中没有幽门螺杆菌或者幽门螺杆菌gyrA基因271位点未发生由G至T的突变,显示阴性扩增曲线,即无扩增信号,提示上述引物对和探针具有良好的特异性和灵敏度。如图4所示:其中蓝色曲线为gyrA271位点突变样本扩增曲线,Ct值为16.8;红色曲线为野生型样本扩增曲线,NO Ct。
实施例5本发明试剂盒对幽门螺杆菌gyrA基因272位点突变耐药性的检测
1.试验样品的确定
将利用药敏试验检测为幽门螺杆菌喹诺酮耐药,且通过测序比对证明gyrA272位点由A突变为G的临床样本作为待检样品。采用柱法或磁珠法抽提细菌基因组DNA,分装后贮存于-80℃。
2.引物和探针的设计:
设计了多对引物和探针,引物长度一般为15-30碱基。
本实施例幽门螺杆菌喹诺酮基因gyrA耐药突变位点A272G引物探针与阻滞序列如下:
272-F:5’CATGGCGATAATGCGGTTTAAGG 3’
272-R:5’CCATGGCGATAATGCGGTTTTTT 3’
272-P:5’HEXGAGAATGGCGCAAGATTTTTCCATGCGBHQ13’
阻滞序列272-blocker:
5’ACCCCCATGGCGATAATGCGGTTTATGA3’-NH2C6。
3.反应体系的优化
3.1引物浓度的优化
在反应体系中其它条件相同的情况下,将272位点引物浓度分别从0.06μM至0.48μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳引物浓度是0.24μM。
3.2探针浓度的优化
在反应体系中其它条件相同的情况下,将272探针浓度分别从0.03μM至0.12μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳探针浓度是0.12μM。
利用上述引物和探针进行反应体系的建立,最后确定采用的幽门螺杆菌耐药突变检测实时荧光PCR反应体系为25μL。
按照一步法荧光定量PCR试剂盒说明进行反应液的配置:
Tris(1M):1μL;KCl(1M):2μL;dNTP(2.5mM):2μL;272-F(20μM):0.3μL;272-R(20μM):0.3μL;272-P(20μM):0.15μL;DNA聚合酶(5U):0.4;H2O:13.85μL;合计:20μL;模板:5μL。
4.仪器检测通道的选择
选择的荧光检测通道应与探针所标记的报告荧光基团一致,具体按照仪器使用说明书进行设置。
5.PCR反应条件如下
95℃2min进行变性反应;95℃10s,55℃40s,40个循环,在55℃40s阶段收集荧光信号。
6.检测结果分析
待检样本中的幽门螺杆菌gyrA基因272位点由A突变为G,显示阳性扩增曲线,其检测灵敏度可以达到1000拷贝/mL;
在对照样本中没有幽门螺杆菌或者幽门螺杆菌gyrA基因272位点未发生由A至G的突变,显示阴性扩增曲线,即无扩增信号,提示上述引物对和探针具有良好的特异性和灵敏度。如图5所示:其中上面曲线为gyrA272位点突变样本扩增曲线,Ct值为17.2;下面曲线为野生型样本扩增曲线,NO Ct。
实施例6本发明试剂盒对幽门螺杆菌23SrRNA基因2142位点突变耐药性的检测
1.试验样品的确定
将利用药敏试验检测为幽门螺杆菌克拉霉素耐药,且通过测序比对证明23SrRNA 2242位点由A突变为C的临床样本作为待检样品。采用柱法或磁珠法抽提细菌基因组DNA,分装后贮存于-80℃。
2.引物和探针的设计:
设计了多对引物和探针,引物长度一般为15-30碱基。
本实施例幽门螺杆菌23SrRNA基因耐药突变位点A2142C引物探针与阻滞序列如下:
2142C-F:5’TCCTACCCGCGGCAAGACTGC 3’
2142C-R:5’CCATAAGAGCCAAAGCCCTTACTTCA 3’
2142C-P:5’FAMTGGGAATATCATGCGCAGGATAGGTGGGAG BHQ13’
阻滞序列2142C-blocker:
5’TCCTCCTACCCGCGGCAAGACGGA3’-NH2C6;
3.反应体系的优化
3.1引物浓度的优化
在反应体系中其它条件相同的情况下,将2142位点引物浓度分别从0.06μM至0.48μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳引物浓度是0.24μM。
3.2探针浓度的优化
在反应体系中其它条件相同的情况下,将2142探针浓度分别从0.03μM至0.24μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳探针浓度是0.12μM。
利用上述引物和探针进行反应体系的建立,最后确定采用的幽门螺杆菌耐药突变检测实时荧光PCR反应体系为25μL。
按照一步法荧光定量PCR试剂盒说明进行反应液的配置:
Tris(1M):1μL;KCl(1M):2μL;dNTP(2.5mM):2μL;2142C-F(20μM):0.3μL;2142C-R(20μM):0.3μL;2142C-P(20μM):0.15μL;DNA聚合酶(5U):0.4;H2O:13.85μL;合计:20μL;模板:5μL。
4.仪器检测通道的选择
选择的荧光检测通道应与探针所标记的报告荧光基团一致,具体按照仪器使用说明书进行设置。
5.PCR反应条件如下
95℃2min进行变性反应;95℃10s,55℃40s,40个循环,在55℃40s阶段收集荧光信号。
6.检测结果分析
待检样本中的幽门螺杆菌23SrRNA基因2142位点由A突变为C,显示阳性扩增曲线,其检测灵敏度可以达到1000拷贝/mL;
在对照样本中没有幽门螺杆菌或者幽门螺杆菌23SrRNA基因2142位点未发生由A至C的突变,显示阴性扩增曲线,即无扩增信号,提示上述引物对和探针具有良好的特异性和灵敏度。如图6所示:其中上面曲线为23SrRNA2142位点突变样本扩增曲线,Ct值为18.7;下面曲线为野生型样本扩增曲线,NO Ct。
实施例7本发明试剂盒对幽门螺杆菌23SrRNA基因2142位点突变耐药性的检测
1.试验样品的确定
将利用药敏试验检测为幽门螺杆菌克拉霉素耐药,且通过测序比对证明23SrRNA 2242位点由A突变为G的临床样本作为待检样品。采用柱法或磁珠法抽提细菌基因组DNA,分装后贮存于-80℃。
2.引物和探针的设计:
设计了多对引物和探针,引物长度一般为15-30碱基。
本实施例幽门螺杆菌23SrRNA基因耐药突变位点A2142G引物探针与阻滞序列如下:
2142G-F:5’CTACCCGCGGCAAGACTGG 3’
2142G-R:5’CCATAAGAGCCAAAGCCCTTACTTCA 3’
2142G-P:5’FAMTGGGAATATCATGCGCAGGATAGGTGGGAG BHQ13’
阻滞序列2142G-blocker:
5’TCCTCCTACCCGCGGCAAGACGGA 3’-NH2C6;
3.反应体系的优化
3.1引物浓度的优化
在反应体系中其它条件相同的情况下,将2142位点引物浓度分别从0.06μM至0.48μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳引物浓度是0.24μM。
3.2探针浓度的优化
在反应体系中其它条件相同的情况下,将2142探针浓度分别从0.03μM至0.24μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳探针浓度是0.12μM。
利用上述引物和探针进行反应体系的建立,最后确定采用的幽门螺杆菌耐药突变检测实时荧光PCR反应体系为25μL。
按照一步法荧光定量PCR试剂盒说明进行反应液的配置:
Tris(1M):1μL;KCl(1M):2μL;dNTP(2.5mM):2μL;2142G-F(20μM):0.3μL;2142G-R(20μM):0.03μL;2142G-P(20μM):0.15μL;DNA聚合酶(5U):0.4;H2O:13.85μL;合计:20μL;模板:5μL。
4.仪器检测通道的选择
选择的荧光检测通道应与探针所标记的报告荧光基团一致,具体按照仪器使用说明书进行设置。
5.PCR反应条件如下
95℃2min进行变性反应;95℃10s,55℃40s,40个循环,在55℃40s阶段收集荧光信号。
6.检测结果分析
待检样本中的幽门螺杆菌23SrRNA基因2142位点由A突变为G,显示阳性扩增曲线,其检测灵敏度可以达到1000拷贝/mL;
在对照样本中没有幽门螺杆菌或者幽门螺杆菌23SrRNA基因2142位点未发生由A至G的突变,显示阴性扩增曲线,即无扩增信号,提示上述引物对和探针具有良好的特异性和灵敏度。如图7所示:其中上面曲线为23SrRNA 2142位点突变样本扩增曲线,Ct值为18.8;下面曲线为野生型样本扩增曲线,NO Ct。
实施例8本发明试剂盒对幽门螺杆菌23SrRNA基因2243位点突变耐药性的检测
1.试验样品的确定
将利用药敏试验检测为幽门螺杆菌克拉霉素耐药,且通过测序比对证明23SrRNA 2243位点由A突变为G的临床样本作为待检样品。采用柱法或磁珠法抽提细菌基因组DNA,分装后贮存于-80℃。
2.引物和探针的设计:
设计了多对引物和探针,引物长度一般为15-30碱基。
本实施例幽门螺杆菌23SrRNA基因耐药突变位点A2143G引物探针与阻滞序列如下:
2143-F:5’TACCCGCGGCAAGACGTAG 3’
2143-R:5’CCATAAGAGCCAAAGCCCTTACTTCA 3’
2143-P:5’FAMTGGGAATATCATGCGCAGGATAGGTGGGAG BHQ13’
阻滞序列2143-blocker:
5’TCCTCCTACCCGCGGCAAGACGGAA3’-NH2C6。
3.反应体系的优化
3.1引物浓度的优化
在反应体系中其它条件相同的情况下,将2143位点引物浓度分别从0.06μM至0.48μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳引物浓度是0.24μM。
3.2探针浓度的优化
在反应体系中其它条件相同的情况下,将2143探针浓度分别从0.03μM至0.24μM作倍比连续稀释,通过对试验结果的分析比较,确定最佳探针浓度是0.12μM。
利用上述引物和探针进行反应体系的建立,最后确定采用的幽门螺杆菌耐药突变检测实时荧光PCR反应体系为25μL。
按照一步法荧光定量PCR试剂盒说明进行反应液的配置:
Tris(1M):1μL;KCl(1M):2μL;dNTP(2.5mM):2μL;2143-F(20μM):0.3μL;2143-R(20μM):0.3μL;2143-P(20μM):0.15μL;DNA聚合酶(5U):0.4;H2O:13.85μL;合计:20μL;模板:5μL。
4.仪器检测通道的选择
选择的荧光检测通道应与探针所标记的报告荧光基团一致,具体按照仪器使用说明书进行设置。
5.PCR反应条件如下
95℃2min进行变性反应;95℃10s,55℃40s,40个循环,在55℃40s阶段收集荧光信号。
6.检测结果分析
待检样本中的幽门螺杆菌23SrRNA基因2143位点由A突变为G,显示阳性扩增曲线,其检测灵敏度可以达到1000拷贝/mL;
在对照样本中没有幽门螺杆菌或者幽门螺杆菌23SrRNA基因2143位点未发生由A至G的突变,显示阴性扩增曲线,即无扩增信号,提示上述引物对和探针具有良好的特异性和灵敏度。如图8所示:其中上面曲线为23SrRNA 2142位点突变样本扩增曲线,Ct值为18.5;下面曲线为野生型样本扩增曲线,NO Ct。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
SEQUENCE LISTING
<110> 江苏默乐生物科技股份有限公司
<120> 一种检测幽门螺杆菌耐药突变位点的试剂盒和方法
<160> 32
<170> PatentIn version 3.5
<210> 1
<211> 18
<212> DNA
<213> 人工序列
<400> 1
accaccccca tggcgatt 18
<210> 2
<211> 22
<212> DNA
<213> 人工序列
<400> 2
cgccatcaat agagccaaag tg 22
<210> 3
<211> 27
<212> DNA
<213> 人工序列
<400> 3
gagaatggcg caagattttt ccatgcg 27
<210> 4
<211> 25
<212> DNA
<213> 人工序列
<400> 4
ggtaaatacc acccccatgg cgata 25
<210> 5
<211> 20
<212> DNA
<213> 人工序列
<400> 5
accaccccca tggcgattag 20
<210> 6
<211> 22
<212> DNA
<213> 人工序列
<400> 6
cgccatcaat agagccaaag tg 22
<210> 7
<211> 27
<212> DNA
<213> 人工序列
<400> 7
gagaatggcg caagattttt ccatgcg 27
<210> 8
<211> 27
<212> DNA
<213> 人工序列
<400> 8
ggtaaatacc acccccatgg cgataat 27
<210> 9
<211> 23
<212> DNA
<213> 人工序列
<400> 9
ccatggcgat aatgcggttt tta 23
<210> 10
<211> 22
<212> DNA
<213> 人工序列
<400> 10
cgccatcaat agagccaaag tg 22
<210> 11
<211> 27
<212> DNA
<213> 人工序列
<400> 11
gagaatggcg caagattttt ccatgcg 27
<210> 12
<211> 27
<212> DNA
<213> 人工序列
<400> 12
acccccatgg cgataatgcg gtttatg 27
<210> 13
<211> 23
<212> DNA
<213> 人工序列
<400> 13
ccatggcgat aatgcggttt tta 23
<210> 14
<211> 23
<212> DNA
<213> 人工序列
<400> 14
ccatggcgat aatgcggttt ttt 23
<210> 15
<211> 27
<212> DNA
<213> 人工序列
<400> 15
gagaatggcg caagattttt ccatgcg 27
<210> 16
<211> 27
<212> DNA
<213> 人工序列
<400> 16
acccccatgg cgataatgcg gtttatg 27
<210> 17
<211> 23
<212> DNA
<213> 人工序列
<400> 17
catggcgata atgcggttta agg 23
<210> 18
<211> 23
<212> DNA
<213> 人工序列
<400> 18
ccatggcgat aatgcggttt ttt 23
<210> 19
<211> 27
<212> DNA
<213> 人工序列
<400> 19
gagaatggcg caagattttt ccatgcg 27
<210> 20
<211> 28
<212> DNA
<213> 人工序列
<400> 20
acccccatgg cgataatgcg gtttatga 28
<210> 21
<211> 21
<212> DNA
<213> 人工序列
<400> 21
tcctacccgc ggcaagactg c 21
<210> 22
<211> 26
<212> DNA
<213> 人工序列
<400> 22
ccataagagc caaagccctt acttca 26
<210> 23
<211> 30
<212> DNA
<213> 人工序列
<400> 23
tgggaatatc atgcgcagga taggtgggag 30
<210> 24
<211> 24
<212> DNA
<213> 人工序列
<400> 24
tcctcctacc cgcggcaaga cgga 24
<210> 25
<211> 19
<212> DNA
<213> 人工序列
<400> 25
ctacccgcgg caagactgg 19
<210> 26
<211> 26
<212> DNA
<213> 人工序列
<400> 26
ccataagagc caaagccctt acttca 26
<210> 27
<211> 30
<212> DNA
<213> 人工序列
<400> 27
tgggaatatc atgcgcagga taggtgggag 30
<210> 28
<211> 24
<212> DNA
<213> 人工序列
<400> 28
tcctcctacc cgcggcaaga cgga 24
<210> 29
<211> 19
<212> DNA
<213> 人工序列
<400> 29
tacccgcggc aagacgtag 19
<210> 30
<211> 26
<212> DNA
<213> 人工序列
<400> 30
ccataagagc caaagccctt acttca 26
<210> 31
<211> 30
<212> DNA
<213> 人工序列
<400> 31
tgggaatatc atgcgcagga taggtgggag 30
<210> 32
<211> 25
<212> DNA
<213> 人工序列
<400> 32
tcctcctacc cgcggcaaga cggaa 25
技术研发人员:吕棠山,王伟伟,李杨霞,陈文铎
技术所有人:江苏默乐生物科技股份有限公司
备 注:该技术已申请专利,仅供学习研究,如用于商业用途,请联系技术所有人。
声 明 :此信息收集于网络,如果你是此专利的发明人不想本网站收录此信息请联系我们,我们会在第一时间删除
